NO ME SALEN
(LECCIONES TEORICAS DE BIOFÍSICA DEL CBC)
FLUIDOS
MECANISMOS DE TRANSPORTE - ÓSMOSIS
|
|

|
| |
El fenómeno osmótico tiene una importancia clínica de primer orden. Todas las membranas de todos nuestros compartimientos internos funcionan osmóticamente, y si no estuviésemos controlando permanentemente y en cada lugar del cuerpo el contenido de nuestros humores acuosos... reventaríamos por todas partes.
Te voy a explicar el fenómeno en un dispositivo súper simplificado. Acá va: |
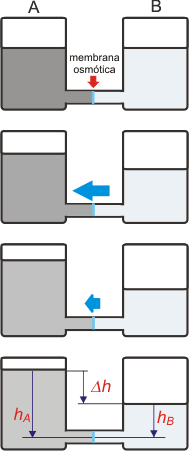
acá tenés dos recipientes de igual tamaño ambos llenos de agua hasta el mismo nivel. Por la parte inferior están conectados con un tubo. Y acá viene la parte más importante: el tubo está cerrado, en el centro (en celeste), con una membrana osmótica. Esta membrana permite el paso del agua en cualquier sentido, pero impide el paso de cualquier otra molécula.
En uno de los recipientes -el A- agregamos un soluto cualquiera. Cualquiera sirve, de modo que elegí uno que dé un poco de coloración a la solución; por eso la ves gris oscuro.
Inmediatamente comienza a subir el nivel de agua del recipiente A y -por ende- a disminuir el equivalente del recipiente B. La conclusión es que se está produciendo una corriente de agua neta (flecha azul) desde el recipiente B hacia el A.
El nivel de A continúa ascendiendo y el de B bajando... pero cada vez con menor velocidad (flecha azul más chica), hasta que llega un momento en que los niveles se estabilizan en una diferencia Δh.
La solución de tinta se fue diluyendo a medida que ingresaba agua pura proveniente de B. Su concentración fue disminuyendo ligeramente. |
|
|
|
|
La interpretación del fenómeno (hacen falta más experimentos) es como sigue: en una membrana que permite el pasaje del agua en ambos sentidos, habrá una corriente neta desde la solución de menor concentración hacia el lado de mayor concentración. |
|
|
El pasaje neto de agua tiende a reducir la diferencia de concentración a ambos lados de una membrana osmótica.
|
|
|
|
| La corriente osmótica obedece a una diferencia de presión, presión osmótica, π, cuya manifestación se neutraliza cuando se equipara con la diferencia de presión hidrostática producida por la diferencia de niveles a ambos lados de la membrana: |
|
|
π = ΔP
|
|
|
| la presión osmótica -que es la que produce la corriente del inicio de nuestro experimento- es proporcional a la diferencia de concentración a ambos lados de la membrana y a la temperatura absoluta a la que ocurre el fenómeno. |
|
|
π = Δc R T |
|
|
| Y R es la constante de los gases ideales. La ecuación que describe el fenómeno osmótico, conocida como ecuación de Van't Hoff, puede corregirse o modificarse levemente para algunas situaciones especiales. Por ejemplo, algunas moléculas se disocian en dos o más partes al entrar en solución, y cada parte de la molécula disociada ejerce su efecto concentrador en forma independiente. De modo que agregamos: |
|
|
π = i Δc R T |
|
|
donde i es el número de partes en que se divide la molécula en solución y se llama coeficiente de disociación.
Pero el caso más general es el que contempla la suma de las concentraciones de cada una de las especies moleculares presentes a cada lado de la membrana. La magnitud que describe esa suma de concentraciones se llama osmolaridad (os) y se mide en las mismas unidades que las concentraciones simples, aunque en vez de decir moles decimos osmoles. |
|
|
π = Δos R T |
|
|
ISOTONICIDAD. Las células están llenas de metabolitos, iones y otras miles de moléculas y porquerías. Un medio acuoso que tenga la misma osmolaridad que la célula se llama isotónico y en él la célula no ganará ni perderá agua por efecto osmótico.
HIPOTONICIDAD. Si arrojamos glóbulos rojos (por ejemplo) en agua pura, la diferencia de osmolaridad entre el interior y el exterior (mayor en las células, menor en el agua) hará que el agua penetre por cuanto poro pueda: los globulitos se hinchan hasta reventar. Ese espectáculo se llama hemólisis.
HIPERTONICIDAD. Un medio es hipertónico cuando su osmolaridad es más alta que la de un cuerpo sumergido en él. Cuando se da este caso, si el cuerpo está envuelto por una membrana osmótica -por ejemplo una membrana celular-, el agua abandona el cuerpo y éste termina achicharrándose por completo. |
|
|
CHISMES IMPORTANTES: |
|

|
- Los medios hipertónicos, como los dulces, son adecuados para permanecer fuera de la heladera: no pueden ser colonizados por bacterias ya que éstas se achicharran inmediatamente y no pueden proliferar. Los dulces no se pudren.
- La osmolaridad del suero está alrededor de 308 mosmoles/L (mili-osmoles por litro). De modo que la solución fisiológica para inyectar por vía venosa a un paciente se compone de agua y cloruro de sodio, NaCl (sal común de mesa), que se logra disolviendo en un litro de agua 9 gramos de sal y adquiere una concentración de 154 mEq de Na y 154 mEq de Cl, o sea, 308 mosmoles/L.
- Tenés un chisme importantísimo en este breve artículo del Maestro Ciruela.
|
|
| PREGUNTAS CAPCIOSAS: |
|
- ¿Por qué las bacterias pueden vivir en agua pura? ¿Por qué no revientan como los glóbulos rojos? ¿Las bacterias no son células, acaso?
- ¿Por qué el método para conservar la carne -antes de que existieran las heladeras- consistía en salarla?
- ¿Qué es esa antigüedad de la salmuera?
- ¿Por qué no puedo calmar la sed bebiendo agua de mar?
|
|
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Última actualización sep-07. Buenos Aires, Argentina. |
|
|
| | |
|
|
![]()
![]()
![]()