NO ME SALEN
(LECCIONES TEORICAS DE BIOFÍSICA DEL CBC)
FLUIDOS
GASES
|
|

|
| |
LEY DE LOS GASES IDEALES O ECUACION DE ESTADO (P V = n R T)
En 1662 Robert Boyle midió con suficiente precisión cantidades de diversos gases (N2, H2 y O2) a diversas presiones, volúmenes y temperaturas. Y encontró que para cierta masa de gas a cierta temperatura constante, el producto entre la presión y el volumen también se mantenía constante. Acá tenés un gráfico que lo describe. |
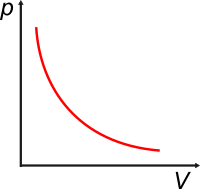 |
La curva se llama isoterma y resulta ser una hipérbola equilátera. La ley que enuncia esta relación se denomina Ley de Boyle-Mariotte:
P . V = cte(m, T)
Esta ley se cumple con independencia del gas que se trate (gases ideales). Según esta ley, mientras se mantenga fija la cantidad de materia y la temperatura a la que se halla, se cumplirá que:
P1 . V1 = P2 . V2
|
|
Trabajando de la misma manera Jacques Charles y Joseph-Louis Gay-Lussac encontraron que el cociente entre la variación de volumen y la variación de temperatura de una cierta masa fija de un gas a presión constante también se mantenía constante. Acá el gráfico que lo describe.
|
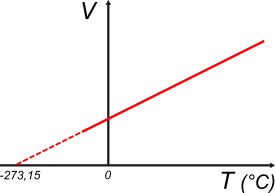 |
Se trata de una recta.
Si extrapolamos esa recta hasta un volumen igual a cero, se obtiene el valor de -273,15 °C. Una temperatura inferior a ella resultaría en un volumen negativo, lo cual carece de sentido. De modo que ese valor de temperatura resulta el más bajo al que se puede llegar y se conoce como 0 absoluto, y es el que da origen a la escala de temperaturas absolutas o escala Kelvin. |
|
|
|
| Adoptada la escala de temperaturas absolutas, el gráfico que describe el hallazgo de Charles y Gay-Lussac adquiere esta pinta: |
|
|
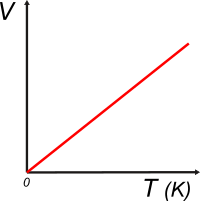 |
La ley de Charles y Gay-Lussac se puede expresar de esta manera: |
|
| Y de ello se desprende que para dos estados, 1 y 2, diferentes (de una masa fija de gas a la misma presión): |
|
|
|
|
| Exactamente de la misma manera encontraron otra ley: la presión y la temperatura absoluta de un gas resultan directamente proporcionales (a volumen constante y para una masa fija de gas). |
|
|
|
|
|
Obviamente se trata de presiones absolutas (presión del vacío = 0).
Si juntamos las tres leyes en una sola, se verifica que para una fija masa de gas y dos estados 1 y 2: |
|
|
| |
P1 . V1 |
= |
P2 . V2 |
|
= cte(m) |
|
|
| T1 |
T2 |
|
|
|
Para pasar de esa relación de proporcionalidades a una igualdad debemos encontrar una constante. La constante R, se define para considerar las masas de gas en moles. Puede ocurrir que todavía no sepas lo que es un mol (acá está). De modo que si desiganamos n al número de moles (la cantidad de moles) nos queda:
P V = n R T
Lo que suele denominarse ecuación de estado de los gases ideales.
El valor de la constante, R (constante de los gases ideales) depende de las unidades en las que midamos los volúmenes y las presiones (la temperatura absoluta se mide en kelvin), Entonces:
R = 8,314 J/mol K
R = 0,08207 l atm/mol K
R = 1,987207 cal/K mol
|
|
|
CHISMES IMPORTANTES |
|
|
- Mol: una colección de un número de Avogadro (6,02 x 1023) de elementos. Por ejemplo en un mol de oxígeno hay 6,02 x 1023 moléculas de O2. El número de Avogadro se designa NA.
- Número de moles (n): cantidad de moléculas, o de átomos, o de cualquier cosa expresada en moles.
- Volumen molar: volumen que ocupa un 1 mol de un gas ideal en condiciones normales de presión y temperatura (1 atm; 0 °C), cuyo valor es 22,414 litros.
- Gas ideal: es uno cuyas moléculas están tan separadas y el volumen de cada una es tan pequeño que muy rara vez se chocan entre sí. Cuanto más diluido esté un gas y menor sea su masa molecular relativa, más se aproxima su comportamiento al de un gas ideal. En este curso no se abordarán otras situaciones.
- Si querés conocer la relación que hay entre la temperatura y la agitación de las moléculas podés ir acá.
|
|
|
| PREGUNTAS CAPCIOSAS |
|
|
| |
|
| |
|

|
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Última actualización jun-21. Buenos Aires, Argentina. |
|
|

| |
|
|

![]()
![]()
![]()
