NO ME SALEN
(APUNTES TEÓRICOS Y EJERCICIOS DE BIOFÍSICA DEL CBC)
CALOR Y TERMODINÁMICA
|
|

|
| |
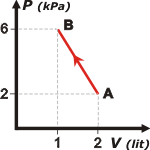
Adicional No me salen 47* - Un gas ideal diatómico evoluciona entre los estados A y B. a) Hallar el calor que el gas intercambia con su entorno si dicho proceso es reversible y sigue la evolución indicada en la figura entre los estados A y B. b) Posteriormente se lleva el gas desde el estado B hasta el estado A mediante un proceso irreversible, cediendo 3 J de calor hacia el ambiente. Hallar el trabajo hecho por el gas en este proceso.¿Es un trabajo entregado o recibido por el gas? |
 |
|
| |
| Este ejercicio perteneció al examen final de Biofísica tomado en noviembre de 2014. |
|
|
|
Es un buen ejercicio. Bastante sencillo conceptualmente, pero lleno de trampas. Para empezar tenés que darte cuenta de que tendrás que usar el primer principio de la termodinámica (si no cazás eso, estás en el horno):
QAB = WAB + ΔUAB
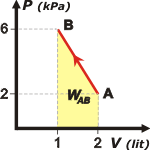
El trabajo es lo más fácil de calcular, ya que nos basta con integrar el área bajo la curva. Se trata de un paralelogramo (o, si querés, la suma de un rectángulo más un triángulo). |
|
|
El rectángulo de abajo nos da 2 kPa.lit, y el triángulo también 2 kPa.lit, de modo que el total es 4 kPa.lit. Pero ¡ojo!, se trata de una reducción de volumen (VA>VB), de modo que el trabajo es negativo.
Esas unidades tan inhomogéneas suelen representar una nueva trampa. ¿Qué es ese producto kPa.lit? Kilo pascales son 1.000 pascales, y litro es lo mismo que la milésima parte del metro cúbico... de modo que:
kPa.lit = 1000 Pa . 0,001 m³ = Pa . m³ = J
|
 |
|
|
|
O sea que la respuesta la obtendremos en joules (y ya no voy a hacer más esta cuenta).
WAB = – 4 J
Ahora vamos con la variación de energía interna. Para eso vamos a tener que tomar en cuenta los datos que aporta el enunciado (se trata de un gas ideal diatómico). Y recordamos que para cualquier evolución de un gas ideal, la variación de energía interna vale:
ΔU = cv n ΔT
(Si no te acordabas de esto, podés verlo acá). Donde cv = 2,5 R, porque se trata de un gas diatómico. Pero no conocemos el número de moles ni la variación de temperatura... qué problema. Como se trata de un gas ideal, podemos hacer uso de la ecuación de estado: P.V = n R T.
TA = PA VA / n R = 4 J / n R
TB = PB VB / n R = 6 J / n R
Entonces:
ΔTAB = 2 J / n R
Ahora metemos eso en la igualdad de la diferencia de energía interna...
ΔUAB = cv n ΔTAB
ΔUAB = 2,5 R n 2 J / n R
ΔUAB = 5 J
Viste... no hizo falta conocer el número de moles, jijij... Bueno, volvamos al primer principio:
QAB = WAB + ΔUAB
QAB = – 4 J + 5 J
|
|
|
|
|
|
Habrás notado que cuando hicimos el cálculo de ΔT obtuvimos un número positivo (no importa que no sepamos el valor de ese número). Es importante que vayas haciendo ese tipo de chequeos durante las resoluciones. Vamos a la segunda pregunta. |
|
|
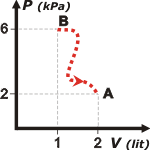
La representación de esta evolución podría ser ésta. La curva que lo representa es una cualquiera (en extremos en los dos estados) pero su traza no puede ser llena, ya que se trata de una evolución irreversible. De todos modos se puede resolver sin necesidad de más consideraciones, con sólo aplicar -nuevamente- el primer principio:
QBA = WBA + ΔUBA
La misma pregunta aporta un dato: el calor cedido durante el proceso vale 3 J. Entonces, teniendo en cuenta nuestra convención: |
 |
|
|
|
QBA = – 3 J
La variación de energía interna es fácil de encontrar, ya que siendo la energía interna una función de estado, no importa para nada el tipo de evolución entre ambos. Si aumentó 5 J para ir desde A hasta B, deberá disminuir la misma cantidad para regresar a A.
ΔUBA = – 5 J
Ahora volvemos al primer principio y resolvemos:
WBA = QBA – ΔUBA
WBA = – 3 J – ( – 5 J)
|
|
|
WBA = 2 J |
entregado por el gas |
|
|
|
| Como ves, se trata de un trabajo positivo, lo que concuerda con un aumento de volumen, y -según nuestra convención- un trabajo hecho por el gas sobre el medio. |
|
|
Desafío:
Si el sistema regresara a B por un camino reversible ¿qué cambiaría? |
|
 |
| |
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. La ecuación de estado nada tiene que ver con los sistemas de gobierno. Última actualización dic-14. Buenos Aires, Argentina. |
|
|
| | |
|
|

