NO ME SALEN
(APUNTES TEÓRICOS Y EJERCICIOS DE BIOFÍSICA DEL CBC)
CALOR Y TERMODINÁMICA
|
|

|
| |
 |
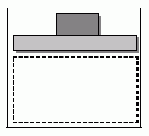
29) Un gas en equilibrio se encuentra en un recipiente cilíndrico
tapado y a una presión de 150 kPa como se muestra en la figura.
La presión del aire exterior es de 100 kPa. El área transversal del
cilindro es de 0,03 m².
Se transfiere calor al gas manteniendo constantes las restantes
condiciones exteriores. Como resultado de ello el pistón se
eleva una distancia de 0,3 m. |
a) ¿Cuál es el trabajo realizado por el gas?
b) ¿Cuál es el trabajo realizado por el sistema constituido por el
pistón y el gas?
c) Si ahora el gas se enfría y el pistón desciende 0,3 m, ¿cuál es el
trabajo realizado por el gas?
d) ¿Bajo qué condiciones la expansión y la compresión descriptas,
serían reversibles? |
 |
|
| |
Este problema es terriblemente fácil (en chileno: harto sencillo); pero guarda unas lecciones fundamentales. Veremos si se las podemos extraer.
Los trabajos realizados por gases (o sobre gases) a presión constante pueden calcularse fácilmente de esta manera:
L = p . ΔV
donde p es la presión exterior al gas (frecuentemente igual a la presión misma del gas) y ΔV es la variación de volumen del gas mientras realiza (o le hacen) el trabajo.
La variación de volumen para todos los casos enunciados es la misma:
ΔV = A . Δy = 0,03 m² . 0,3 m = 0,009 m3,
que en el caso a) y b) será positivo (aumento de volumen) y en el caso c) negativo (disminución de volumen).
El cálculo del trabajo para el caso a) es muy sencillo; la presión exterior al gas, la presión que lo comprime, es igual a la del propio gas: 150 kPa, de modo que
La) = pext . ΔV = 150 kPa . 0,009 m3 =
|
|
|
|
|
|
La situación b) cuesta un poco más verla. Nos piden que consideremos un sistema integrado por el gas más el pistón que tiene arriba. Podemos operar con el sistema del mismo modo que lo hicimos con el gas, pero ahora no cabe duda de que la presión externa al sistema es otra: 100 kPa, la atmosférica. Entonces:
Lb) = pext' . ΔV = 100 kPa . 0,009 m3 =
|
|
Tal vez no te diste cuenta, pero...
100 kPa es casi lo mismo que 1 atm, la presión atmosférica. |
|
|
|
|
Ahora nos piden que volvamos a considerar el sistema constituido sólo por el gas pero, ahora, en una reducción de volumen (el medio realiza un trabajo sobre el sistema).
Lc) = pext . ΔV = 150 kPa . (– 0,009 m3) =
|
|
|
|
|
|
| Para que la expansión o la compresión sean reversibles tienen que atravesar por estados definibles, cosa que no es fácil. La entrada de calor hace variar la temperatura, pero no es fácil que la variación se reparta uniformemente. Al variar el volumen de un gas suelen producirse remolinos y corrientes que hacen imposible definir un estado homogéneo para todo el gas (todo a la misma presión, todo a la misma temperatura). De modo que el método que más se va a aproximar a una transformación reversible será aquel que se produzca con la menor perturbación del sistema... |
|
|
en un equilibrio constante, muy lentamente.
|
|
|
|
| ¿Lograste extraerle alguna enseñanza importante? Si es así, el ejercicio 37 no te va a presentar dificultades mayores. |
|
 |
| DESAFIO: Explicarle a un niño de 10 años cómo es posible que arriba del pistón haya una presión de 100 y abajo de 150. |
|
| |
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Nunca debe apretarse un pistón sin antes saber dónde se halla el pistón. Última actualización abr-08. Buenos Aires, Argentina. |
|
|
| | |
|
|

