|
NO ME SALEN
(APUNTES TEÓRICOS DE BIOFÍSICA DEL CBC)
ENTROPIA
|
|

|
| |
CÁLCULO DE LA VARIACIÓN DE ENTROPÍA PARA EL CALENTAMIENTO O ENFRIAMIENTO DE UN CUERPO SIMPLE
Se trata de la suma exhaustiva de todos los cocientes entre los pequeños intercambios de calor divididos la temperatura absoluta a la que se realizaron esos intercambios, pero con la condición de que el calor intercambiado lo haya sido en una transformación de tipo reversible... |
| |
| |
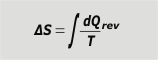 |
variación de entropía |
|
|
|
Recordemos que un cuerpo simple es aquel cuya energía interna depende exclusivamente de su temperatura. (Los seres vivos no son cuerpos simples ya que su energía interna es fundamentalmente química. Un paquete de trotyl tampoco es un cuerpo simple, obvio). Un cuerpo simple puede ser, por ejemplo, un trozo de plomo, o un cuerpo de agua.
Supongamos que queremos calcular la variación de entropía de cierta masa de agua que varía su temperatura sin cambiar de estado. Tendremos que realizar la siguiente operación: |
|
|
|
|
|
O sea, sumar todas las pequeñísimas cantidades de calor recibidas, dQ (diferencial de calor), cada una divida por la temperatura absoluta, T, a la que se recibió ese calor. Porque claro, cada cantidad de calor -aunque pequeña- hará aumentar la temperatura del cuerpo, según recuerdo algo de calorimetría:
dQ = c m dT
Donde c es el calor específico del agua y m su masa. Cada pequeña cantidad de calor, un pequeño aumento de temperatura.
Podemos reemplazar dQ en la fórmula de la variación de entropía: |
|
|
|
|
|
| c y m son constantes de modo que pueden quedar fuera de la integral. |
|
|
|
|
|
| Ahora es fácil encontrar el resultado de la integral: |
|
|
|
|
|
Prestale atención a este ejemplo sencillísimo.
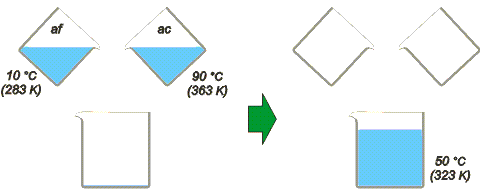
Tenemos medio litro de agua a 10 ºC y lo mezclamos con otro medio litro a 90 ºC. Es obvio que casi inmediatamente obtendremos un litro a 50 ºC. Se trata del ejercicio más sencillo que te puede tocar en calorimetría que, por lo demás, es tremendamente intuitivo. Bien, en este caso pondremos la lupa sobre las variaciones de entropía. |
|
|
 |
|
|
Llamaremos af al cuerpo de agua fría y ac al cuerpo de agua caliente. Recordá que el calor específico del agua vale c = 4,2 J/gK y que las temperaturas hay que expresarlas en escala absoluta indefectiblemente. Entonces: |
|
|
|
|
|
| ΔSaf = 4,2 J/gK . 500 g . ln |
|
|
|
|
ΔSaf = 277 J/K
De la misma manera calculamos la variación de entropía del agua caliente: |
|
|
| ΔSac = 4,2 J/gK . 500 g . ln |
|
|
|
|
ΔSac = –245 J/K
Como ves, el agua fría aumentó su entropía (porque recibió calor) y el agua caliente disminuyó su entropía ya que cedió calor. Pero surge otra particularidad tremendamente reveladora: la entropía total (la del universo) habrá aumentado.
ΔSu = ΔSaf + ΔSac = 277 J/K – 245 J/K = 32 J/K
Analicemos un poquito este resultado. Para empezar podemos suponer que en el corto tiempo en que se produjo la mezcla el ambiente no cedió ni recibió calor. Eso nos habilita a pensar que la variación de entropía del universo (durante el proceso de la mezcla) es la misma que ocurre en sistema al que podemos considerar aislado (las aguas y los recipientes).
Pero lo más importante es que el resultado se inscribe en el segundo principio de la termodinámica, que dice que en cualquier proceso la entropía del universo aumenta y que se trata de un proceso irreversible. |
|
|
|
|
|
| En muchos libros de física y en muchos cursos se aplica el concepto de entropía a transformaciones con gases ideales o al menos simples (como el vapor de agua). El motivo es que la simplicidad de los sistemas ayuda a entender e incorporar el concepto, y por otro lado, tiene importancia práctica (por los motores a pistón). |
|
|
| En el universo no hay marcha atrás |
|
|
| |
|
|
| CHISMES IMPORTANTES |
|
|
- La primera vez que los estudiantes resuelven ejercicios sobre variación de entropía es probable que confundan la función ln con log. Todo se aprende.
|
|
|
| PREGUNTAS CAPCIOSAS |
|
 |
- Si las moléculas de los gases se mueven aleatoriamente sin ninguna ley que los gobierne individualmente... ¿por qué es que nunca ocurre que alguien se asfixie en una habitación porque las moléculas de oxígeno aparecieron todas ubicadas en el lado opuesto al chabón?
|
|
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Última actualización jul-09. Buenos Aires, Argentina. |
|
|
 |
| | |
|
|