NO ME SALEN
(PROBLEMAS RESUELTOS DE BIOFÍSICA DEL CBC)
FLUIDOS
|
|

|
| |

|
29) Un cilindro de 30 cm³ está comunicado con un recipiente que contiene agua a 27 °C (a
esa temperatura la presión de vapor del agua es de 2,7 cm de Hg). En el cilindro hay
vapor de agua y nitrógeno gaseoso. La presión dentro del cilindro es de 1 atm. ¿Cuántos moles de nitrógeno hay en el cilindro? |
En este ejercicio, bastante sencillo como verás, se enfrenta un error muy común entre los estudiantes; te lo voy a marcar cuando lleguemos. Por lo pronto, como vamos a tener que trabajar con varias magnitudes, pasémoslas todas a un sistema de unidades homogéneo. Propongo litros/atmósferas, que es bastante utilizado en clínica. |
|
|
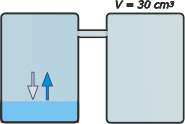
|
El cilindro nuestro es el de la derecha, que tiene un volumen de 30 cm³, o sea de 0,03 L.
Al estar conectado a un recipiente con agua, y al estar todo cerrado, en muy poco tiempo se llega a la saturación de vapor... de modo que debemos considerar que tenemos un ambiente saturado de vapor y a 27ºC. Por lo tanto la presión de vapor de agua en el cilindro será de 2,7 cmHg o su equivalente: 0,0355 atm. |
|
|
|
¿Cómo podemos, a partir de los datos anteriores, sacar alguna información sobre el otro gas presente, el nitrógeno, N2? Con el concepto de presión parcial. La presión total, PTOT -que es dato en este ejercicio, y vale 1 atm-, es la suma de las presiones parciales de los gases presentes... en este caso sólo dos: el nitrógeno y el agua.
prTOT = prN2 + prH2O
prN2 = prTOT – prH2O
prN2 = 1 atm – 0,0355 atm = 0,9645 atm
Para conocer la cantidad en moles de N2 basta con aplicar la ecuación de estado de los gases ideales (vamos a concederle ese privilegio al N2). Ojo: la temperatura, en escala absoluta.
prN2 V = nN2 R T
nN2 = prN2 V / R T
nN2 = 0,9645 atm . 0,03 L / 0,082 (lit atm/mol K) . 300 K
|
|
|
|
|
|
El error común en el que caen los estudiantes es que quieren repartir también el volumen entre los gases presentes. Y no. Todos los gases presentes comparten (y tienen) el mismo volumen, que no es otro que el volumen del recipiente.
Aunque no lo piden -y ya que resultó más sencillo de lo que vos pensabas- calculemos las masas presentes de cada gas:
mN2 = MRN2 . nN2 = 28 g/mol . 1,18 x10-3 moles
mN2 = 33,04 mg
mH2O = MRH2O . nH2O = 18 g/mol . 4,33 x10-5 moles
mH2O = 0,78 mg
Y somos unos capos. |
|
|
DESAFÍO: ¿De dónde saqué el número de moles de agua? ¿Cuánto valen las fracciones molares de cada gas presente? ¿Qué resultados de todos los hallados y los preguntados en este mismo desafío cambiarían, si la presión total en el cilindro fuese de 1,7 atm? |
|

|
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Última actualización may-08. Buenos Aires, Argentina. |
|
|
| | |
|
|

![]()
![]()
![]()
