NO ME SALEN
(APUNTES TEÓRICOS Y EJERCICIOS DE BIOFÍSICA DEL CBC)
CALOR Y TERMODINÁMICA
|
|

|
| |
Adicional NMS 11* - Dos moles de un gas monoatómico ideal se expanden cinco veces su volumen inicial, en forma reversible, en una evolución isotérmica a 50ºC. Se pide hallar:
a) El trabajo desarrollado por el gas y la variación de energía interna.
b) La variación de entropía del sistema. |
|
| |
Bueno... que no cunda el pánico. Intentaremos resolverlo como si fuese un ejercicio difícil. Concentrémonos. Un poco más... así, así... ya casi... no te rías que es peor... |
|
|
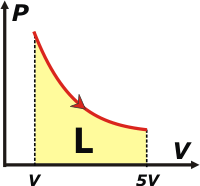 |
Acá tenemos el gráfico p-v que nos muestra la evolución reversible isotérmica a 323 K.
Para hallar el trabajo debemos remitirnos a la ecuación correspondiente:
L = n R T ln (VF /V0)
L = n R T ln (5V/V)
L = n R T ln 5
Todo lo demás son datos... |
|
|
|
L = 2 mol . 0,08207 lt.atm/K mol . 323 K . ln 5
|
|
|
| |
|
|
| Tratándose de un gas ideal, la energía interna depende exclusivamente de su temperatura, y al no variar esta, tampoco varía su energía interna. |
|
|
|
|
|
Para hallar la variación de entropía, dado que la transformación fue reversible e isoterma, basta con aplicar la definición ΔS = Q/T.
Por aplicación del Primer Principio, sabemos que en este caso el calor intercambiado será igual al trabajo efectuado (un trabajo positivo), Q = L, de modo que...
ΔS = 85,33 lt.atm / 323 K
|
|
|
|
|
|
| |
|
 |
Desafío: ¿Me podrías dar los resultados en cal, J, cal/K y J/K? |
|
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Última actualización jul-09. Buenos Aires, Argentina. |
|
|
| | |
|
|

