NO ME SALEN
(PROBLEMAS RESUELTOS DE BIOFÍSICA DEL CBC)
FLUIDOS
|
|

|
| |

|
30) En un recipiente de 1 litro, en el que previamente se ha hecho vacío, se tiene agua
líquida en equilibrio con su vapor, a 80 °C. Si el número total de moles de la mezcla es 2, ¿cuántos moles de agua líquida y cuántos moles de vapor hay?
Datos: Buscando en tablas se encuentra que, a 80 ºC, un mol de agua ocupa en estado
líquido 0,0185 litros, y en estado gaseoso 61,1 litros. |
No le temas, este ejercicio tiene una dificultad física de nivel -3; apunta todos los cañones a investigar si sos capaz de hacer planteos abstractos y traducir el lenguaje coloquial a ecuaciones o relaciones algebraicas. Es sólo eso. Intentalo de nuevo sin mi ayuda y después volvé, que además de resolverlo, te hago unas observaciones finales que te pueden resultar interesantes. Andá. |
|
|
Yo siempre me hago un esquemita, ¿viste? (me dicen esquemático...) Bueno, voy a llamar x a la cantidad de moles de agua en estado gaseoso, e y a la cantidad de moles de agua en estado líquido. Según el enunciado del problema tenemos que
x + y = 2 moles [1]
La parte gaseosa ocupa un volumen Vx, y la parte líquida un volumen Vy. Según el enunciado se cumplirá que: |
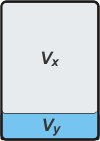
|
|
|
|
Vx + Vy = 1 L [2]
El enunciado aporta algunos datos muy útiles, por ejemplo que la relación entre el volumen que ocupa el vapor a esa temperatura y la cantidad de moles de vapor que haya vale siempre:
Vx / x = 61,1 L/mol [3]
Y también nos da la relación entre el volumen de agua líquida y la cantidad de moles:
Vy / y = 0,0185 L/mol [4]
En definitiva tenés un sistema de cuatro ecuaciones con cuatro incógnitas. ¡4x4! ¡Qué miedo... estoy por desmayarme!
Hay 20.000 formas diferentes de resolver el sistema. Lo importante es que te des cuenta que esto tiene solución algebraica. Que la parte física del ejercicio ya la resolviste, que lo que te queda es álgebra -no física-, que podés tardar 5 minutos en resolverlo o 45... pero que lo que falta no debe entorpecer tu comprensión del funcionamiento del universo, que eso es la física.
Dale, te ayudo a resolverlo para que no llores. De la [3] despejo Vx, y de la [4] Vy.
Vx = x . 61,1 L/mol
Vy = y . 0,0185 L/mol
meto ambas en la ecuación [2]
x . 61,1 L/mol + y . 0,0185 L/mol = 1lit
Ya puedo cancelar esos litros. Paso los moles que están dividiendo en el primer miembro, multiplicando al segundo. De la [1] despejo y, y lo meto en la anterior:
x . 61,1 + (2 mol – x) . 0,0185 = 1 mol
distribuyo el producto en el paréntesis; reagrupo y despejo x... |
|
|
|
|
|
El resto es pan comido... pero aprovecho la redundancia algebraica para verificar que los resultados sean correctos. Se trata de cantidades muy ajustadas, muy extremas, de modo que si no trabajás con suficientes cifras decimales se te descalabran las sumas y no llegás a verificar nada. En estos casos te aconsejo trabajar con todas las cifras decimales que te permita tu calculadora y redondear sólo en los resultados finales para no hacer papelones (*). |
|
|
y = 1,9842 moles
Vx = 0,9629 L y Vy = 0,0371 L |
|
|
|
| OBSERVACION: Si recordás que un mol de agua tiene una masa de 18 gramos, entonces la relación volumen-moles se puede convertir en una relación volumen-masa, o masa-volumen... ¡eso es densidad! Y ahora que lo recuerdo la densidad del agua líquida es tan conocida como La Cumparsita: ρ = 1.000 g/L. Pero resulta que a partir del dato del ejercicio (un mol de agua ocupa en estado
líquido 0,0185 litros) la densidad me da ρ' = 973 g/L . |
|
|
| (*) Hacés papelón cuando expresás tus resultados con una cantidad ridícula (por exceso) de cifras decimales, inútiles, irrisorias, irreales, insignificantes... También hacés papelón (por defecto) cuando ponés menos de las correctas al punto de alterar la parte significativa del resultado. Es todo una ciencia colocar la cantidad correcta de cifras decimales, y no siempre hay un único criterio. En este ejercicio utilicé el criterio de expresar tantas cifras decimales como el dato más preciso del enunciado. Que te aproveche. |
|
|
|
DESAFÍO: Explicar la aparente incongruencia de la observación, hacer una hipótesis y verificarla. Una vez logrado, encarar la cuestión similar de la densidad del vapor, que es un poco más difícil, pero que también se puede reducir -en este caso- a conceptos generales de gases ideales. |
|

|
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Última actualización
ene-08. Buenos Aires, Argentina. |
|
|
| | |
|
|

![]()
![]()
![]()
