NO ME SALEN
(LECCIONES TEORICAS DE BIOFÍSICA DEL CBC)
FLUIDOS
HUMEDAD RELATIVA AMBIENTE
|
|

|
| |
EQUILIBRIO LIQUIDO-VAPOR – PRESION DE VAPOR
Todos los líquidos se evaporan: algunos más rápido, otros más lentamente. De los primeros decimos que son volátiles, como el alcohol. Vamos a estudiar este fenómeno en particular para el agua y la humedad, con un poco más de detalle.
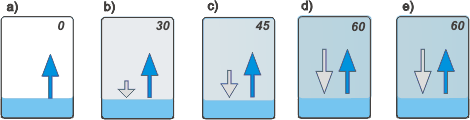
Supongamos un recipiente cerrado en el que hay aire seco (absolutamente seco, sin una sola molécula de agua volando) y en el que se introduce un poco de agua. Mirá la ilustración.
a) Inmediatamente algunas moléculas de agua traspasan la superficie y salen volando, pasando al estado gaseoso e integrando una fase nueva: el vapor (este proceso se llama evaporación). Los numeritos representan la cantidad (hipotética) de moléculas que están volando (en el inicio no hay ninguna, acordate que en el recipiente había aire seco).
b) Le siguen más y más moléculas que pasan de la fase líquida a la fase gaseosa. Algunas moléculas retornan a la fase líquida (eso es la condensación); al principio pocas, porque no había muchas volando en la fase gaseosa.
c) A medida que la fase vapor se va poblando de más y más moléculas, la velocidad de retorno va creciendo, hasta que se iguala con la velocidad de despegue y se alcanza un equilibrio dinámico. Supongamos que en ese momento hay 60 moléculas en la fase gaseosa.
d) La misma cantidad de moléculas que pasan del estado líquido al estado gaseoso, pasan del gaseoso al líquido. Si 7 moléculas nuevas se evaporan, otras 7 se condensan. Aunque dejemos pasar dos horas... seguirá habiendo 60 moléculas en la fase gaseosa. Es lo que se llama un equilibrio dinámico. |
|
|
|
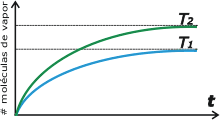
La presión parcial de la humedad en la fase gaseosa de agua que partió de cero alcanzó un valor constante. Este valor se llama presión de vapor de saturación, y sólo depende de la temperatura a la que se realiza el experimento. Por ejemplo, si el mismo experimento lo hubiésemos realizado un día más caluroso, en lugar de alcanzar el equilibrio en 60 moléculas, lo habría alcanzado en -por ejemplo- 85. Acá tenés un gráfico que cuenta lo mismo que el experimento que te acabo de narrar. |
|
|
|
La cantidad de moléculas que tenés en la fase gaseosa va aumentando a medida que transcurre el tiempo (curva celeste). Y se aproxima asintóticamente a un valor constante, que no va a superar. Cuando llega a ese estado decimos que el volumen se halla saturado.
Si el experimento ocurre a una temperatura mayor (T2 > T1) la cantidad de moléculas en la saturación será mayor (curva verde). |
|
|
|
| Los valores alcanzados en la saturación son muy robustos. Y a todos los experimentadores les dan los mismos valores: las cantidades en la saturación son siempre los mismos y dependen exclusivamente de la temperatura. Es sorprendente que sea independiente de la presión total que haya en el recipiente debido a la presencia de otros gases: las moléculas de vapor de agua se comportan como si fueran lo único que existe en el universo. Esas cantidades de vapor en el momento de la saturación están consignados en tablas como ésta: |
|
|
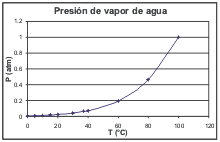
Presión de vapor de agua a diferentes temperaturas |
T (°C) |
P (atm) |
P (kPa) |
0 |
0,00626 |
0,612 |
5 |
0,00856 |
0,871 |
10 |
0,0121 |
1,226 |
15 |
0,0168 |
1,70 |
20 |
0,0230 |
2,33 |
25 |
0,0313 |
3,17 |
30 |
0,0418 |
4,24 |
37 |
0,0621 |
6,29 |
40 |
0,0728 |
7,38 |
60 |
0,196 |
19,94 |
80 |
0,466 |
47,35 |
100 |
1,00 |
101,3 |
120 |
1,96 |
198,5 |
130 |
2,67 |
270,1 |
|
Notemos algunas cosas:
En la escala de temperaturas elegida hay más detalle entre 0 y 30 grados ya que son las temperaturas ambientales comunes, y los valores consignados tienen importancia para establecer la humedad del ambiente.
La temperatura 37 grados está consignada porque es la temperatura corporal, y a veces la de la piel (habitualmente es más fría); la transpiración (básicamente agua) se evapora a la temperatura de la piel.
A 100ºC la presión de vapor es 1 atm. Eso quiere decir que a 100 grados toda la masa líquida pasa a la fase gaseosa, a la atmósfera... ¡como si el agua entrara en ebullición! (mmm, eso ya lo sabíamos).
Y entonces, a 2 atm, el agua hierve a 120ºC (como en el autoclave).
En el gráfico de presiones de vapor lo único que hice fue llevar los valores de la tabla, de modo que ambos -tabla y gráfico- sirven también como tabla o gráfico de puntos de ebullición. Eso quiere decir que a diferentes presiones la temperatura de ebullición no va a ser la misma. |
|
|
|
|
IMPORTANTE:
Supongamos que estamos en la etapa d) del experimento, es decir, la presión de vapor ya fue alcanzada en la temperatura en la que estemos trabajando. ¿Qué pasaría si añadiéramos un poco de vapor extra con una jeringa? Inmediatamente aumentaría la velocidad de retorno a la fase líquida (condensación) y se restablecería la presión de vapor al valor de tabla. La condensación puede ocurrir no sólo en la superficie del líquido sino también en las paredes del recipiente, o en cualquier parte. O sea que la presión de vapor establece el máximo de vapor que puede coexistir con la fase líquida, pero puede haber menos.
HUMEDAD RELATIVA AMBIENTE
La humedad relativa ambiente (Hr) indica no sólo que el locutor de la radio se quedó sin tema, sino qué porcentaje de vapor está presente en el ambiente en relación con el máximo permitido para la temperatura de ese día, o sea, cuánto hay respecto de lo máximo que podría haber.
Por ejemplo: el día del experimento de la ilustración de arriba, en la etapa b) la humedad relativa adentro del recipiente era 50%; y en la etapa c) era 75%. Refácil.
De modo que: |
|
|
| Hr = |
|
masa de vapor presente |
|
|
|
|
|
| máxima masa de vapor (T) |
|
|
|
|
| Hr = |
|
presión de vapor presente |
|
|
|
|
|
| máxima presión de vapor (T) |
|
|
|
|
A la presión de vapor también se la llama presión de vapor saturado, que indica -de mejor manera- que se trata de un máximo y que no admite más vapor y que todo exceso o añadido será condensado. Como ya sabés es un valor que depende de la temperatura: es el valor que figura en la tabla.
TEMPERATURA DE ROCIO
Hagamos de nuevo el experimento pero al revés. Supongamos que tenemos un recipiente cerrado que contiene una cierta cantidad de vapor, menor que la máxima permitida por la saturación: digamos humedad relativa igual al 60%. Ahora disminuyamos lentamente la temperatura. Como el recipiente es cerrado la cantidad de vapor no varía, pero al bajar la temperatura disminuye la cantidad máxima soportada por el recipiente y por lo tanto aumenta la humedad relativa. Pasa de 60% a 80%... y si sigue disminuyendo la temperatura, sigue aumentando la humedad relativa. Y si continuamos enfriando el ambiente llegará el momento en que la humedad relativa alcance el 100%: llegará el momento en que la cantidad de vapor encerrada sea igual a la máxima admitida por el ambiente interno. A esa temperatura se la denomina temperatura de rocío (Trocío). Una décima de grado menos y ya se empiezan a formar gotitas de rocío en las paredes del recipiente.
¿Qué pasó? Pasó que al seguir disminuyendo la temperatura, la cantidad de vapor que había en el recipiente se hizo mayor que la tolerada y comenzó a condensarse en minúsculas gotas. La temperatura de rocío sirve también para conocer la humedad relativa |
|
|
| Hr = |
|
presión vap. (T rocío) |
|
|
|
|
|
| presión vap. (T amb) |
|
|
|
|
OTRA CUESTIÓN IMPORTANTE
Fijate que todo lo dicho hasta acá es independiente de la presión (y la cantidad de aire) en el medio. La humedad relativa -y la humedad de saturación- es un fenómeno que sólo concierne a la humedad (o sea, a las moléculas de agua) y a la temperatura. No interviene ni el espacio que ocupa ni las otras moléculas presentes en ese espacio. En los ejercicios sobre humedad obtendríamos los mismos resultados si el fenómeno ocurre en el aire, en el vacío, en el gas metano o en una mezcla de gases tóxicos. |
|
|
CHISMES IMPORTANTES |
|
|
- En La Paz, Bolivia, a 3.600 metros sobre el nivel del mar, la presión atmosférica suele ser menor que 760 mmHg, y el agua hierve a menos de
100 °C. Las comidas tardan más en cocinarse o tienen otro sabor. Por el contrario, la olla a presión (cosa de abuelas) gracias a su tapa hermética alcanza fácilmente las 2 atmósferas, y el agua hierve a 120 °C, con lo que la comida tarda mucho menos en cocinarse y obtiene otro sabor.
- En los hospitales se usa una olla a presión de 30 litros o más, llamada autoclave, que sirve para esterilizar todo lo que sea menester (menos termómetros, of course).
- Un modo sencillo de medir la humedad relativa ambiente es de esta manera: miran el termómetro de la pared, que por ejemplo indica 20 grados. Después toman una jarrita de acero inoxidable llena de agua y le van echando cubitos de hielo adentro para enfriarla. Van controlando la temperatura del agua con un termómetro y van mirando la superficie exterior de la jarra atentamente. En determinado momento observan que la superficie se empaña. Ahí leen el termómetro. La lectura es, por ejemplo, 5 grados. Luego buscan la tabla de presiones de vapor de agua y se fijan los valores para esas dos temperaturas. Después hacen esta cuentita:
|
|
|
| Hr = |
|
presión vap. (T rocío) |
= |
0,00856 |
= 0,37 = 37% |
|
|
| presión vap. (T amb) |
0,0230 |
|
|
|
| |
En los servicios meteorológicos se mide la humedad relativa con un artefacto llamado psicrómetro, que posee dos termómetros, uno de bulbo seco y otro húmedo, y que también utiliza la propiedad de la temperatura de rocío. |
|
|
|
| PREGUNTAS CAPCIOSAS |
|
|
- ¿Por qué a la tarde, cuando baja el sol y la temperatura, el pasto se moja sin que la vecina lo riegue?
- ¿Por qué a la mañana tempranito, cuando la temperatura disminuyó tanto, suelen encontrarse los autos estacionados todos bañados de rocío?
- ¿Por qué es tan sofocante el verano en Buenos Aires, y en Cancún -en bermudas y con temperaturas más elevadas- uno se siente menos acalorado?
- ¿Por qué se empaña el vidrio cuando le soplamos el aliento?
- ¿Por qué cuando sacamos las botellas de la heladera se mojan por fuera y mamá protesta porque no pusimos los posavasos?
- ¿Por qué los días de mucho frío parece que echáramos humo por la nariz?
- ¿Por qué se ve el chorrito de vapor que sale de la pava hirviendo, si la humedad es totalmente transparente?
- ¿De qué están hechas las nubes? Si de humedad fuera... ¿no tendrían que ser transparentes?
|
|

|
| |
|
|
| |
|
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Última actualización sep-07. Buenos Aires, lo que mata es la humedad. |
|
|

|
| | |
|
|

![]()
![]()
![]()
