NO ME SALEN
(APUNTES TEÓRICOS Y EJERCICIOS DE BIOFÍSICA DEL CBC)
CALOR Y TERMODINÁMICA
|
|

|
| |
 |
31) Un volumen de 200 litros de agua a 15°C, contenido en un recipiente adiabático rígido, se
calienta por medio de una resistencia eléctrica conectada a una batería, que entrega
2.500 calorías al agua. Calcule el calor intercambiado, el trabajo y la variación de la
energía interna, considerando como sistema:
a) el agua
b) el agua y la resistencia
c) el agua, la resistencia y la fuente.
Nota: suponga que en la batería no se producen pérdidas de energía, que las capacidades
caloríficas del recipiente y de la resistencia son despreciables y que el trabajo de volumen
debido a la dilatación del agua es insignificante. Explique en qué pasos de su desarrollo
necesita hacer estas suposiciones para poder dar, con los datos dados, una respuesta
numérica. |
|
| |
El objetivo de este ejercicio -y lo logra- es mostrarte qué importante es definir el sistema que pretendés describir con el primer principio de la termodinámica:
Q = ΔU + L
puesto que las respuestas cambian absolutamente dependiendo de ello. |
|
L y W
son símbolos indistintos para trabajo |
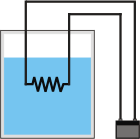 |
Acá tenemos el conjunto de los tres elementos dispuestos para la tarea. En cada caso iré pintando de rojo al sistema al cual nos referimos. |
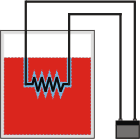 |
En el caso del agua sola está claro que recibe 2.500 calorías, y eso hace aumentar su temperatura... por lo que no cabe duda de que aumenta su energía interna. Todavía no sabemos en cuánto. Pero advertimos que el agua no hace ningún trabajo ni recibe tampoco, debido a que su volumen es invariante. De modo que si el trabajo es cero, la variación de energía interna debe ser igual al calor recibido. |
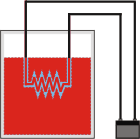 |
La resistencia es la que le entrega calor al agua. De modo que el calor neto vale cero (2.500 recibe el agua y 2.500 cede la resistencia). Ya sabíamos cuánto valía la variación de energía interna desde el paso anterior, y ahora no cambió nada porque la resistencia no se calienta (su calor específico es despreciable), y por lo tanto sigue valiendo 2.500 calorías. El sistema recibe un trabajo eléctrico que hace la batería al mover cargas. |
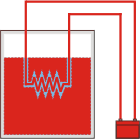 |
El calor nuevamente es cero, por las mismas consideraciones que hice en el caso anterior: la resistencia cede y el agua recibe la misma cantidad. Respecto a la variación de la energía interna ahora vale cero, porque si bien el agua aumentó su temperatura y así su energía interna, la batería disminuyó su energía química en una cantidad igual. El trabajo eléctrico que recibió la resistencia "salió" de la batería, luego ahora también hubo trabajo... pero ahora es un trabajo interno: su suma neta vale cero. |
|
|
|
| Volcamos todos los resultados en un cuadro. |
|
|
| SISTEMA |
Q |
ΔU |
L |
| agua |
2.500 |
2.500 |
0 |
| agua + resistencia |
0 |
2.500 |
- 2.500 |
| agua + resistencia + batería |
0 |
0 |
0 |
|
|
|
|
|
|
 |
| Desafío: No fui explícito en mencionar las características de la Nota del enunciado cuando las usé... pero lo hice. ¿Te animarías a identificarlas? |
|
| |
|
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Para bañarde en agua caliente calentada por un calentador eléctrico es recomendable quitar el calentador antes de meter el dedo. Última actualización nov-07. Buenos Aires, Argentina. |
|
|
| | |
|
|

