NO ME SALEN
(APUNTES TEÓRICOS Y EJERCICIOS DE BIOFÍSICA DEL CBC)
CALOR Y TERMODINÁMICA
|
|

|
| |
 |
5) ¿Cuántas calorías requiere un bloque de hielo de 40 kg a –20°C para pasar, a presión
atmosférica normal, al estado:
a) líquido a 40°C.
b) vapor a 100°C.
c) 20 kg. de líquido a 100 °C en equilibrio con su vapor.
(Considere Lf = 80 cal/g; Lv = 540 cal/g y c,hielo = 0,5 cal/g°C) |
|
| |
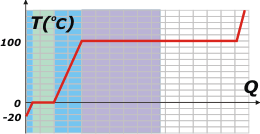
Este ejercicio es sencillo... pero fundamental. Dejemos el ejercicio para el final. primero te voy a mostrar una curva de calentamiento del agua, que es independiente de la masa de agua que estemos calentando (porque no le puse valores al calor recibido por el cuerpo de agua). |
|
|
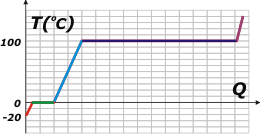 |
Te la voy a leer de izquierda a derecha. El asunto comienza a una temperatura de -20ºC. Al recibir calor, como cualquier cuerpo... aumenta la temperatura. Si la potencia con la que se recibe el calor es constante, el aumento de temperatura también será constante y la gráfica se corresponderá con una recta oblicua ascendente de pendiente típica (es el tramo rojo). Después te hago el cálculo del calor total necesario para que la temperatura alcance los 0ºC. |
|
|
|
La cuestión es que al alcanzar los 0ºC la gráfica se aplana mostrando que la temperatura deja de aumentar. No es que haya cesado el aporte de calor... es que el hielo se está derritiendo. Los tramos horizontales de la gráfica (tramo verde) representan cambios de estado.
Cuando toda la masa de hielo se derritió, recién ahí el agua comienza a aumentar su temperatura (tramo celeste). Si te fijás, la pendiente (la inclinación) del segmento celeste es bastante menor que la del segmento rojo. Eso nos está describiendo que el agua líquida es mas "dura" de calentar que el agua sólida. De hecho, el agua líquida es una de las sustancias más difíciles de calentar... hay que suministrarle mucho calor para que varíe su temperatura.
Al llegar a los 100ºC vuelve a plancharse la gráfica. Es otro cambio de estado: de líquido a gaseoso. Justo en inicio, cuando el agua alcanza los 100ºC, rompe el hervor, y mientras el agua hierve se va evaporando. Si el flujo de calor se mantiene constante el segmento que representa ese cambio de estado es tan largo como lo hice -en comparación con el verde-. Se trata de otra particularidad atípica del agua: que necesite tanto calor para evaporarse. La cuestión es que ése es el motivo por el cual podemos cocinar los fideos con cierta tranquilidad. Mi abuela, apenas comenzaba el hervor, bajaba el fuego de la hornalla, y así lograba que esa recta en lugar de larga fuera larguísima, entonces metía las verduras confiada de que podía dedicarse a otra tarea sin peligro de que el agua se evapore totalmente y la comida se malogre.
El resto no es fácil de hacer en la cocina, pero si pudiésemos retener el vapor para calentarlo, la gráfica sería muy parecida a la del hielo, ya que requiere más o menos la misma cantidad de calor para obtener los mismos aumentos de temperatura. (tramo violeta). |
|
|
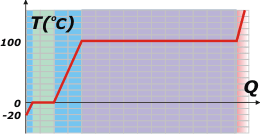 |
Te voy a calcular esas cantidades de calor necesarias durante todo el proceso para esta masa de 40 kg.
La primera cantidad de calor, que voy a llamar QH, se calcula de esta manera:
QH = m cH . (TFH – T0H) |
|
|
|
QH = 40 kg 0,5 (kcal/kg°C) (0°C + 20°C)
QH = 400 kcal
La cantidad de calor necesaria para fundir todo el hielo, QF:
QF = m LF
QF = 40 kg 80 (kcal/kg)
QF = 3.200 kcal
La cantidad de calor necesaria para llevar el agua -ya líquida- de 0 a 100 grados, QL:
QL = m cL . (TFL – T0L)
QL = 40 kg 1 (kcal/kg°C) (100°C – 0°C)
QL = 4.000 kcal
La cantidad de calor necesaria para evaporar íntegramente los cuarenta litros de agua, QV:
QV = m LV
QV = 40 kg 540 (kcal/kg)
QV = 21.600 kcal
El calor para elevar la temperatura del vapor sabrías cómo calcularlo, pero deberías tener una temperatura final.
Ahora sí, vamos al ejercicio. Empecemos por el ítem a). |
|
|
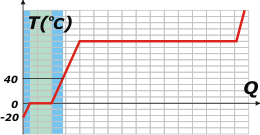 |
Para llevar desde los -20°C a los 40°C finales del ítem a) habrá que sumar el calor necesario para calentar el hielo, el calor para derretirlo, con el calor -que todavía no calculamos- para llevar el agua líquida de 0 a 40 grados.
Calculemos este último, al que llamaré Q1. |
|
|
|
Q1 = 40 kg 1 (kcal/kg°C) (40°C – 0°C) = 1.600 kcal
Por lo tanto, el calor necesario para lograr el objetivo del ítem a), Qa, será:
Qa = QH + QF + Q1
Qa = 400 kcal + 3.200 kcal + 1.600 kcal
|
|
|
|
|
|
Vamos al ítem b). |
|
|
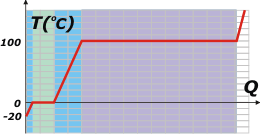 |
El calor necesario para llevar esos 40 kilos de hielo a -20 grados iniciales hasta el vapor (cantidad de calor que llamaré Qb) será la suma de las cantidades de calor necesarias para cada etapa de la transformación.
Por suerte ya las calculamos a todas previamente: |
|
|
|
Qb = QH + QF + QL + QV
Qb = 400 kcal + 3.200 kcal + 4.000 kcal + 21.600 kcal
|
|
|
|
|
|
Y ahora vamos al último ítem, el c). |
|
|
 |
Nuevamente, el calor necesario para llevar esos 40 kilos de hielo a -20 grados hasta evaporar la mitad (cantidad de calor que llamaré Qc) será la suma de las cantidades de calor necesarias para cada etapa de la transformación.
Están todas calculadas menos una, la última, que podríamos llamar Q2. |
|
|
|
Q2 = m2 LV
Q2 = 20 kg 540 (kcal/kg)
Q2 =10.800 kcal
Ahora sí, la cantidad de calor Qc valdrá:
Qc = 400 kcal + 3.200 kcal + 4.000 kcal + 10.800 kcal
|
|
|
|
|
|
Desafío:
¿Por qué tantas especies habrán elegido la transpiración (elegir es una manera de decir) como método fundamental de refrigeración? |
|
 |
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Si un ejercicio de calorimetría no te sale... no te calientes. Última actualización jul-08. Buenos Aires, Argentina. |
|
|
| | |
|
|

