 |
NO ME SALEN
(APUNTES TEÓRICOS DE BIOFÍSICA DEL CBC)
ENTROPIA
|
|

|
| |
ENTROPÍA, LA FLECHA DEL TIEMPO: LA MAGNITUD QUE SIEMPRE AUMENTA
El Segundo Principio de la Termodinámica (2do. Ppio.) se convierte en una ley fuertemente predictiva y con un potencial de cálculo muy grande gracias al concepto de entropía, S.
¿Pero qué es la entropía? Yo no fui capaz de explicarte qué es la energía y pretendés que te explique qué es la entropía... ni lo sueñes. Te puedo dar algunas pistas... pero sólo vas a arribar a una idea cabal de la entropía usándola, midiendo sus cambios, prestando atención a lo que nos dice de cada transformación del universo... Y no arrugues, porque la entropía es uno de los conceptos más bellos de la Física.
Ideas asociadas y características
- la entropía se emparenta con el desorden; hay quien afirma que la entropía es una medida del desorden presente en un sistema: y a mayor desorden, mayor entropía.
- Los aumentos de entropía se asocian a la degradación de la energía (energía útil, que puede ser transformada en trabajo -por ejemplo- se degrada a energía inútil, que aún estando, no puede ser aprovechada).
- la entropía es un escalar (como la energía), no tiene ni dirección ni sentido, es sólo un número, con sus unidades.
- de la entropía (como de la energía) no interesa saber cuánto vale sino cuánto aumenta o cuánto disminuye, o si se mantiene constante. La mayoría de las veces ni siquiera es posible el cálculo de la cantidad de entropía, S, en cambio es sencillo conocer lo que verdaderamente interesa, su variación, ΔS.
- La entropía es una función de estado, (como P, V, T, U) lo que significa que vale lo mismo si las condiciones son idénticas, no depende de la historia del sistema ni del proceso que realiza (como Q, L).
La variación de entropía
Se trata de la suma exhaustiva de todos los cocientes entre los pequeños intercambios de calor divididos la temperatura absoluta a la que se realizaron esos intercambios, pero con la condición de que el calor intercambiado lo haya sido en una transformación de tipo reversible... Cuánto palabrerío. Miralo así: |
| |
| |
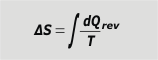 |
variación de entropía |
|
|
|
| Si en la transformación cuya variación de entropía queremos estudiar la temperatura se mantuvo constante... entonces la suma integral queda mucho más sencilla. |
|
|
| |
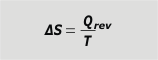 |
variación de entropía a T constante |
|
|
|
Los cálculos de variación de entropía son muy útiles, y en muchísimos casos vas a poder calcularla fácilmente con esa última definición. Las unidades internacionales para entropía serán: [S] = J/K, (Joule sobre Kelvin). ¿Pero qué es Qrev?
Calor reversible, Qrev
No existe un calor reversible... no te asustes. Es el nombre que se le da al calor intercambiado en una transformación reversible. Ahora sí podés asustarte... porque las transformaciones reversibles tampoco existen. En nuestro universo está prohibido volver atrás. Una pequeña porción de universo sí puede volver atrás (por ejemplo: nada te impide volver a leer este apunte desde el principio porque te diste cuenta que requiere ser leído con más atención)... pero el universo, en su conjunto, no puede.
Y si las transformaciones reversibles no existen... ¿a qué nos referimos cuando hablamos de ellas? Nos estamos refiriendo justo a ese límite infranqueable, al que podemos acercamos pero nunca traspasar. Lo que se llama una transformación ideal.
Puede ocurrir que una transformación proceda sin intercambio de calor. ¿Se puede calcular la variación de entropía para ese proceso? Sí: hay que conocer el estado inicial y final del proceso, e imaginar una evolución reversible cualquiera (puede haber muchas) que los conecte. Esa evolución, seguramente, no tendrá nada que ver con la original, pero la variación de entropía será la misma, ya que la entropía es una función de estado (no depende del "camino" que haya tomado el sistema).
¿Qué características tienen esas transformaciones ideales, reversibles? En este otro apunte las describo con un poco más de detalle, pero lo que a vos te interesa a los fines del cálculo es que las transformaciones ideales se llevan a cabo pasando por una sucesión de estados definidos, donde todos los parámetros que describen la transformación (por ejemplo temperatura, presión, volumen, etcétera) se conocen con certeza.
La entropía y el segundo principio
La formulación del Segundo Principio de la Termodinámica que implica a la entropía dice escuetamente: en cualquier transformación, la entropía del universo aumenta: |
|
|
|
|
|
| Prestale atención a este ejemplo sencillísimo. |
|
|
 |
En un vaso metés la mitad de agua caliente (ac) y la mitad de agua fría (af). El calor que el agua caliente le cede al agua fría, es igual al calor que el agua fría recibe del agua caliente. Después de mezclarse suficientemente ambas partes terminan a la misma temperatura.
El agua fría aumentó su entropía y el agua caliente la disminuyó. Sin embargo, en valor absoluto, el aumento de la entropía del agua fría es mayor que la disminución de la caliente... por lo que la entropía total del sistema habrá aumentado.
¿De dónde salió esa entropía adicional? La respuesta es que ha sido creada durante el proceso de la mezcla. Y ya no puede volverse atrás: esa cantidad de entropía recién creada ya no puede ser destruída, el universo deberá cargar con ese aumento por toda la eternidad. En símbolos: |
|
|
| Tenés un ejercicio de este mismo ejemplo en el apunte teórico siguiente. |
|
ΔSac + ΔSaf > 0 (con ΔSac < 0 y ΔSaf > 0 )
El signo de la variación de entropía (o sea, si aumenta o disminuye) lo da el numerador de la definición de variación de entropía, ya que el denominador (la temperatura absoluta) es siempre positiva. Por lo tanto si un cuerpo cede calor disminuirá su entropía (ΔS < 0) y si un cuerpo recibe calor, aumentará su entropía (ΔS > 0).
Variación de entropía en una máquina térmica
Resulta asombrosamente descriptiva la aplicación del 2do. Ppio (versión entropía) al funcionamiento de una máquina térmica: |
|
|
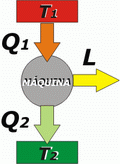 |
hay tres cuerpos presentes en este funcionamiento: la fuente caliente, la fuente fría y la máquina propiamente dicha. Luego, la variación de entropía total, o sea, la variación de entropía del universo, será igual a la suma de las variaciones de entropía de cada cuerpo:
ΔS1 + ΔSM + ΔS2 > 0
la máquina funciona cíclicamente volviendo constantemente al mismo estado. Por lo tanto no varía su entropía, ΔSM = 0. |
|
|
|
Los otros dos cuerpos, por ser fuentes, no varían su temperatura, de modo que nos facilitarán enormemente el cálculo de su variación de entropía: |
|
|
|
|
|
Q1 es un calor cedido por la fuente caliente, por lo tanto, a los fines del cálculo de la variación de entropía de la fuente caliente, ese calor es negativo. |
|
|
|
|
|
Todas las máquinas térmicas funcionan de manera tal que el cociente entre el calor desperdiciado dividido la temperatura a la que se produce la pérdida, es mayor que el cociente entre el calor tomado de la fuente caliente dividido la temperatura de la fuente.
¿Cuánto mayor tiene que ser el primer miembro que el segundo?
El segundo principio no lo dice... dice solamente que tiene que ser mayor. 3 veces mayor, dos veces, 1,2 veces, 0,1 vez mayor, 0,00001 vez... el límite (argucia física, no real) de este razonamiento es que los cocientes pueden llegar a ser iguales. A esa situación límite la llamamos ideal.
Pero en una máquina ideal, una máquina perfecta, el primer miembro será igual al segundo. Y transformará energía calórica en energía mecánica de un modo reversible, ideal y con el máximo rendimiento posible. En esa máquina ideal que descubrió el francés Sadi Carnot bastante antes de que se postulase el 2do. Ppio., se estará cumpliendo que... |
|
|
|
|
|
O lo que es lo mismo: |
|
|
|
|
|
y su rendimiento (máximo rendimiento posible): |
|
|
| η = 1 – |
Q2 |
= 1 – |
T2 |
|
|
|
| Q1 |
T1 |
|
|
|
| cuando los ingenieros vieron esta conclusión rápidamente salieron a fabricar máquinas con calderas más calientes, y con vertedores (radiadores) más fríos. Las industrias se mudaron a las márgenes de los ríos o costas marítimas. Los industriales se forraron de guita y el Planeta empezó a calentarse. No te calientes. |
|
|
| |
|
|
| La entropía... ya no es lo que era... |
|
|
| |
|
|
| CHISMES IMPORTANTES |
|
|
- La palabra "entropie" fue acuñada por Rudolph Clausius en Berlín en 1854.
- Otra definición de entropía: Es la función de estado que mide la probabilidad de que un sistema cerrado se aproxime al equilibrio térmico.
- Y otra más, de corte estadístico: el incremento de la entropía señala el paso de un sistema de estado menos probable a otro estado más probable.
- El primero en señalar que valorar la entropía era equivalente a valorar el desorden fue Hermann von Helmholtz (1821-1894).
- Otro modo sencillo de medir el aumento de la entropía es cuantificar el desperdicio, la basura, la contaminación ambiental. Los economistas suelen olvidarse de que el 2do. principio no descansa. No existe una producción limpia, siempre se generan desperdicios. No se puede producir, producir y producir sin contaminar, contaminar y contaminar.
- Sigmund Freud leyó alguna cosa sobre el aumento de la entropía del universo y de ahí derivó la teoría del instinto de muerte. ¡Y millones de personas se lo creyeron! ¡No es joda!
|
|
|
| PREGUNTAS CAPCIOSAS |
|
|
- Algunos científicos describieron el fenómeno vida termodinámicamente de la siguiente manera: la vida es una máquina de disminuir la entropía; generar más vida significa disminuir más la entropía. Poéticamente: un grito desesperado de la materia contra la entropía. Se trata de una descripción muy bonita y ajustada a la realidad, pero... ¿esto no viola el segundo principio?
|
|
 |
| |
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente. Última actualización jul-09. Buenos Aires, Argentina. |
|
|
 |
| | |
|
|

