 |
NO ME SALEN
(APUNTES TEÓRICOS DE BIOFÍSICA DEL CBC)
PRIMER PRINCIPIO DE LA TERMODINÁMICA
|
|

|
| |
Primer Principio de la Termodinámica
El primer principio no es otra cosa que la forma que el principio general de la conservación de la energía adopta acá, en el barrio de la termodinámica. Sin embargo, por haber sido la formulación original algunos físicos reclaman para ésta (la de la termodinámica) una preminencia especial. Vos dejalos que se peleen, no te importa.
El principio general de la conservación de la energía venía a decir algo así como que |
| |
| |
La energía no se crea ni se destruye, sólo se transforma. |
(1) |
|
|
|
| Para entender la pinta que adopta en la termodinámica, vamos a remontarnos a la revolución industrial y a tratar de describir lo que le ocurre a una máquina cualquiera (recién inventada) cuando se pone en funcionamiento y empieza a trabajar. |
|
|
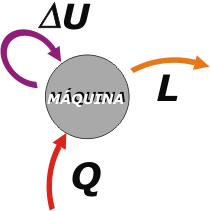 |
Lo que viene ahora es importante, ya que hace las veces de sistema de referencia: vamos a centrarnos en el punto de vista de la máquina.
Resulta que para que la máquina funcione es necesario que reciba una cierta cantidad de calor, Q, que habitualmente proviene de una caldera, una cámara de combustión o cualquier otro lugar donde uno quema el combustible que compró en la estación de servicio o no importa dónde.
¿Qué hace la máquina con esa energía en forma de calor que le entregamos? En parte la usa para calentarse a sí misma. Esa parte es un poco inútil, indeseada (a nadie le gusta que sus máquinas calienten), pero no puede evitarse. |
|
|
no te olvides que el calor es una forma de energía
|
|
Ese calentamiento de la máquina queda almacenado (al menos temporalmente) como una energía interna, U (en realidad como un aumento de su energía interna, ΔU, ya que no podemos pretender que antes valiese cero), y que en este caso depende exclusivamente de la temperatura. Más adelante veremos que otros cuerpos -más sofisticados que una máquina de hierro- puede almacenar energía interna de otras formas más variadas.
Y la parte más interesante de lo que la máquina hace con la energía que le entregamos es: trabajar, L, hacer algo que deseemos (mover las ruedas de una locomotora, la hélice de un barco, urdimbres de un telar, whatever). L y W son símbolos aceptados para trabajo y los usaré indistintamente.
Repasemos: Q es el calor que se le entrega a la máquina. ΔU es la variación de energía interna de la máquina. Y L es el trabajo que brinda la máquina. El primer principio de la termodinámica asegura que: |
|
|
|
|
W o L
son símbolos alternativos para
trabajo |
|
|
| Pero también ocurre que las máquinas pierden calor (cualquiera sabe que cerca de una máquina en funcionamiento las cosas se ponen calentitas, que no hay que tocarlas para no quemarse, y que tiran chorros de fuego por los escapes o las chimeneas, o por donde se las deje). |
|
|
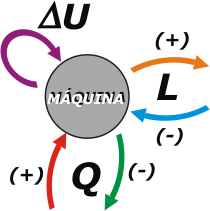 |
Al calor recibido por la máquina vamos a asignarle signo positivo. Al calor despedido por la máquina, signo negativo.
Para ser exquisitos (en adelante será una necesidad) también puede ocurrir que en lugar de que la máquina realice un trabajo sobre el medio circundante, sea el medio quien realice trabajo sobre la máquina. Ese trabajo será negativo.
Estas dos últimas son convenciones de signos (podríamos haberlas planteado a la inversa, pero la tradición obliga). La variación de energía interna no requiere convención de signos ya que se trata, justamente, de una variación entre dos estados. Si hay aumento (final menos inicial) dará positivo, si hay disminución dará negativo. |
|
|
El criterio para la convención de signos es el adoptado por la IUPAC |
| La variación de energía interna -en una máquina- sólo es apreciable cuando la máquina arranca (a la mañana tempranito) o cuando se apaga. Pero a régimen constante, trabajando siempre a la misma temperatura, durante toda la jornada de producción, la variación de energía interna es nula. Acordate que estamos hablando de una máquina, un objeto simple, que su único modo de acumular energía interna es con la temperatura (con la agitación de sus moléculas). Lo mismo le ocurre a los gases ideales. |
|
|
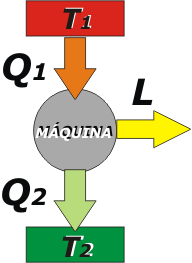 |
Entonces, si tenemos una máquina operando a régimen constante, suele representarse con un esquema de este estilo, en el que no aparece ΔU, la variación de energía interna, y en el que la fuente de calor (la caldera o lo que sea) se muestra separada de la fuente sumidero (el ambiente que recibe el calor desperdiciado).
En termodinámica llamamos fuente a un cuerpo que entrega o recibe calor y no varía su temperatura. Tal es el caso de una caldera bien atendida: si el fogonero se preocupa que no falte leña, entregará su calor, Q1, sin disminuir su temperatura, T1. Lo dicho vale para cualquier cámara de combustión.
Y también es el caso del sumidero de calor desperdiciado, Q2, que recibe el calor sin aumentar la temperatura, T2, -en este caso- por tratarse del medio ambiente, que es inmenso comparado con la máquina. |
|
|
|
| Esta descripción archi-importante (porque es exportable a variadísimos casos, no sólo máquinas) si la describimos con el primer principio, quedará así: |
|
|
| |
Q1 – Q2 = L |
régimen constante: (ΔU = 0) |
|
|
|
| Si llegaste hasta acá, hacé un esfuercito más y leé el chusmerío siguiente. |
|
|
| CHISMES IMPORTANTES |
|
|
- Por algún motivo la mayoría de los libros de texto presentan el primer principio de ésta manera: ΔU = Q – L, que es equivalente a la mía. Yo te recomiendo que uses mi formulación y no la de los libros, y que reserves la asignación de signos para la convención recibido/entregado (muchos estudiantes meten la pata cuando enfrentan una doble asignación de signos). Además, si querés plantear el primer principio de memoria, mi formulación es sencilla de recordar: el calor recibido se usa para esto y para esto otro, a = b + c. En cambio con la otra formulación... ¿cómo era? ¿Q–L o L–Q...? Bueno... qué querés... yo soy tonto.
- El primer principio de la termodinámica, como lo plantea el espíritu de este apunte fue concebido para describir el funcionamiento de las máquinas y motores que surgieron durante la revolución industrial. Pero con posterioridad se vio que era fecundamente descriptivo para cualquier sistema, simples, complejos, inertes, ¡y vivos!
- El principal aporte de energía, cuando se trata de un organismo vivo, es la energía química que ingresa con el alimento... que deviene en un aumento de la energía interna, ΔU. Un mecanismo muy particular, llamado hambre, nos indica que hay que volver a aumentar la energía interna para seguir realizando trabajos o perdiendo calor... o sea, para seguir viviendo.
- Francis Bacon, Robert Hooke e
Isaac Newton mantenían en el siglo XVII que el calor era una propiedad del cuerpo
calentado y resultaba del movimiento vibratorio o agitación de sus partes. Le pegaron en el palo.
- La primera formulación del primer principio se debe a Saadi Carnot y data de 1850. Ya estaba establecida la relación entre el calor y el trabajo gracias a los trabajos de James Prescott Joule, William Thomsom (lord Kelvin), Rudolf Clausius y otros. Carnot le agregó el asunto de la variación de energía interna y con ese detalle le puso el moño al principio.
|
|
|
| PREGUNTAS CAPCIOSAS |
|
|
- ¿Puede ser que haya un principio cero de la termodinámica, y que a mí se me haya pasado?
|
|
|
|
|
|
(1) En realidad la energía sí puede variar su cantidad total, ya que puede convertirse en materia, y viceversa, la materia puede convertirse en energía. (O sea: en realidad sí se crea y sí se destruye). Este es un importante descubrimiento que realizó Einstein en el marco de la Teoría de la Relatividad Especial, que incluye la famosa ecuación de equivalencia entre materia y energía: E=mc² (donde E es la energía, m es la masa y c es la velocidad de la luz). Pero tanto el principio de conservación de la materia como el principio de conservación de la energía se enuncian a implícita excepción de la ocurrencia de fenómenos relativistas, que están restringidos a las bombas atómicas, las centrales nucleares, los núcleos estelares y algunas interacciones subatómicas.
Pero en el marco de la mecánica clásica (o sea, este curso de Física) podemos obviar todos los efectos relativistas y dar por válido el Principio de Conservación de la Energía tal como lo enuncié más arriba. |
|
|
 |
| |
| |
|
|
| Algunos derechos reservados.
Se permite su reproducción citando la fuente, de todos modos, se recomienda aguardar hasta tener un hogar en el que afincar una familia. Última actualización jul-09. Buenos Aires, Argentina. |
|
|
 |
| | |
|
|

